As vacinas revolucionaram a medicina e continuam salvando vidas. Não existem dúvidas sobre sua importância e o impacto positivo de campanhas de vacinação para a prevenção de doenças, algumas das quais parecem hoje memórias de um passado distante. Isso também faz com que as pessoas se sintam mais seguras e comecem a perder a perspectiva da real contribuição das vacinas; se eu nunca vi alguém com a doença X e eu não sei direito como a vacina anti-X funciona, talvez eu ache melhor não me vacinar ou não vacinar meus filhos. Em um mundo cheio de teorias da conspiração, não é difícil encontrar na internet argumentos (normalmente infundados) para se ter medo de vacinas. Infelizmente os EUA recentemente vivenciaram um processo deste tipo, o que acabou resultando na maior epidemia de Sarampo em décadas [1].
Existem vários aspectos envolvidos neste problema e um deles diz respeito a falta de informação do público leigo sobre como as vacinas funcionam, bem como nossa dificuldade de comunicar ciência para leigos. E no contexto de vacinas isso se torna ainda mais complicado porque de fato existem vários detalhes que são ignorados inclusive por profissionais da saúde. Há décadas nós sabemos “usar” as vacinas em nosso proveito, mas existem vários detalhes do funcionamento do sistema imunológico e dos mecanismos de memória que só agora começam a ser desvendados. Precisamos evidenciar a importância das vacinas e tranquilizar o público sobre a segurança das vacinas que usamos. Ao mesmo tempo, precisamos nos atualizar e descobrir formas de educar a população, para com o tempo fazermos um uso ainda mais adequado desta tecnologia fantástica que são as vacinas.
Por exemplo, uma questão que precisa ser considerada é que toda a vacinação tem uma consequência permanente no sistema imunológico do indivíduo. E esta alteração não é apenas no sentido de expandir o repertório de defesa. Se o sistema imunológico de um indivíduo fosse um álbum de figurinhas, originalmente pensaríamos que cada vacinação (ou infecção) adicionaria uma figurinha no álbum. “Consegui anti-Sarampo, agora quero a da febre amarela e muitas outras”. Neste sentido o álbum precisaria ser infinito e quanto mais vacinas, melhor. Mas a medida que compreendemos mecanismos relacionados a memória imunológica, fica cada vez mais evidente que não é tão simples. Nosso álbum tem um certo limite de posições e a cada vacinação nós reordenamos as figurinhas, decidimos quais são as nossas favoritas e inclusive jogamos algumas fora.
Uma revisão publicada no ano passado [2] aborda estas questões, com enfoque na resposta imunológica celular. Cada indivíduo tem um repertório único de linfócitos T citotóxicos (especificidade privada), graças aos mecanismos de geração de variabilidade na produção dos receptores de linfócitos T (TCRs). E a cada nova imunização, seja por infecção ou vacinação, ocorre uma alteração permanente neste repertório. Algumas linhagens de célula T serão expandidas em resposta ao novo desafio, enquanto outras serão reduzidas. Embora estimulados de forma específica por um dado “antígeno” (peptídeo no contexto do HLA), linfócitos T podem reconhecer antígenos heterólogos (reatividade cruzada) e é sabido que o contato com um dado patógeno pode conferir imunidade parcial contra um patógeno diferente (imunidade heteróloga). Do mesmo modo, este reconhecimento cruzado também pode desencadear uma resposta crônica (ineficiente) contra o patógeno heterólogo, ou mesmo mediar uma imunopatologia. Portanto nem todas as consequências de uma imunização são necessariamente positivas, depende da especificidade privada e do histórico imunológico (histórico de imunizações) [2].
A reatividade cruzada parece ser essencial para a manutenção do repertório de memória de linfócitos T. Considerando-se que existe um volume limitado para abrigar o repertório de linfócitos T de um indivíduo e que não seria viável guardar um linfócito para cada patógeno encontrado ao longo da vida, uma forma de otimizar este sistema seria justamente priorizar células que apresentam reatividade cruzada (um linfócito T pode proteger contra múltiplos “alvos”) [3]. No entanto, existe uma relação de compromisso (ou “perde-e-ganha”). Estes linfócitos usualmente apresentam menor afinidade e especificidade do que outros clones, o que pode significar uma resposta menos eficiente. Mais do que isso, trabalhos em imunidade heteróloga demonstram que existe um “estreitamento da resposta” após desafios heterólogos consecutivos [4, 5]. Ou seja, nós temos um repertório diverso de linfócitos T (policlonal), mas após desafios consecutivos com patógenos diferentes ocorre um “estreitamento” deste repertório (se torna oligoclonal), favorecendo células que reconhecem ambos os patógenos (ou ambas as variantes do patógeno). Um estudo em humanos observou o mesmo fenômeno com relação a exposição repetida a variantes do vírus da gripe [6]. Somos expostos regularmente a novas variantes do vírus da gripe e com o passar dos anos isso vai estreitando o nosso repertório de linfócitos T e reduzindo nossa capacidade de responder a variantes que sejam significativamente diferentes.
A revisão de 2015 [2] discute que devem haver mecanismos para minimizar este estreitamento de repertório. Modelos computacionais sugerem que deve haver uma eliminação ativa de algumas populações de memória para forçar a seleção de populações completamente novas de linfócitos T; evitando assim que em poucas rodadas de imunização nosso repertório fosse dominado por uma população de células altamente “promíscuas”. Mas isso implica que a cada nova imunização nós corremos o risco de reduzir (ou perder) a imunidade contra um patógeno que encontramos previamente.
Ou seja, em toda a vacinação existe uma relação de compromisso e talvez seja preciso repensar nossas políticas de vacinação para levar isso em consideração. Não é algo impossível, visto que em certos contextos nós já fazemos este tipo de avaliação. Por exemplo, apesar de ser difícil convencer amigos e familiares, é impossível “pegar gripe” à partir da vacina da gripe. Simplesmente porque a vacina da gripe não contém o vírus ativo, mas apenas proteínas do vírus. É possível que a vacina não seja protetora, mas é impossível a vacina causar a doença. Portanto, do ponto de vista de segurança da vacina, não existe contra indicação (ignorando aqui alguma rara reação adversa ao adjuvante). A situação é um pouco diferente no caso de vacinas de vírus atenuados. Apesar de serem bastante seguras, estas vacinas contêm partículas viáveis do vírus e existe um risco não desprezível de que a vacina cause a doença. Justamente por isso, nós restringimos o uso deste tipo de vacina aos grupos de risco. Por exemplo, se você não vive em uma área de risco para febre amarela, a probabilidade de você se infectar com este vírus (selvagem) é menor do que a probabilidade de você contrair a doença a partir da variante vacinal. Então é melhor não vacinar. Por outro lado, se você mora ou vai visitar uma região endêmica para a doença, a probabilidade de se infectar com o vírus selvagem e ter todas as consequências da doença é muito maior do que o minúsculo risco apresentado pela vacina. Então é melhor se vacinar.
O que a revisão de 2015 [2] argumenta é que o mesmo tipo de relação de compromisso deve ser considerada em qualquer vacinação. Não corremos risco de desenvolver gripe a partir da vacina da gripe, mas a vacina vai sem dúvida alterar permanentemente o nosso repertório de linfócitos T. Se somos parte de um grupo de risco para as complicações associadas a gripe, então o risco de nos infectarmos pelo vírus selvagem é maior do que o risco de causarmos um “estreitamento” na nossa resposta, portanto devemos nos vacinar. Mas se somos indivíduos saudáveis e fora dos grupos de risco, a pequena chance de termos complicações não compensa o “comprometimento” do nosso repertório de células T. Portanto não seria necessário vacinar, pelo menos não todos os anos. Mas veja bem, não significa que não há risco de um jovem saudável não vacinado se infectar com o vírus da gripe e ter complicações graves (e até fatais). Mas é uma questão de probabilidades e prioridades. E também é preciso relembrar que não controlamos completamente nosso histórico imunológico; podemos decidir se tomamos a vacina da gripe todos os anos, mas não podemos decidir se seremos ou não expostos aos vírus da gripe que estão circulando no nosso ambiente.
Infelizmente, não parece haver uma resposta simples ou um esquema de vacinações perfeito. Depende de vários fatores. Esta complexidade dificulta ainda mais a nossa comunicação com o público e pode ser confundida com insegurança sobre o tema. No entanto, compreender a complexidade do problema e considerar os riscos e benefícios de acordo com o que sabemos nos coloca em uma melhor posição para tomarmos decisões acertadas (tanto individualmente, como em termos de políticas públicas).
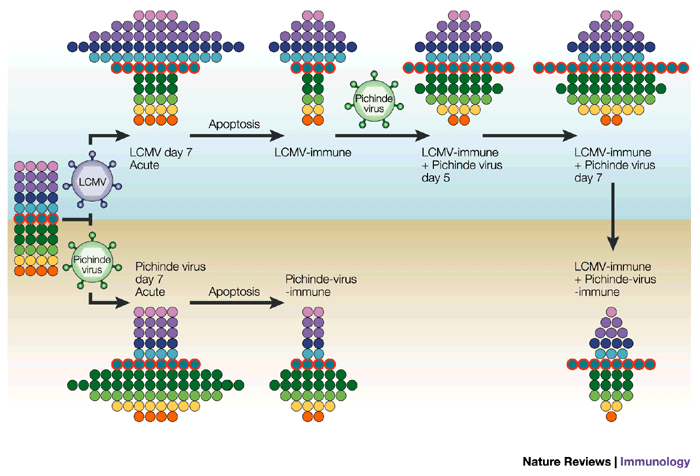
Representação esquemática de como diferentes históricos de infecção levam ao desenvolvimento de diferentes repertórios de células T, mesmo considerando um repertório inicial idêntico. Observe que em ambos os casos (quadro superior e inferior) infecções sucessivas com vírus distintos favorecem a expansão de células capazes de reconhecer alvos de ambos os vírus (células apresentando reatividade cruzada, representadas como círculos azuis e com contorno laranja). A figura também representa uma etapa de apoptose após o desafio com o vírus, indicando a redução numérica das populações que não foram estimuladas (em relação ao repertório inicial). Figura publicada por Welsh & Selin, 2002 (https://www.ncbi.nlm.nih.gov/pubmed/12093008)
Autor: Dinler Amaral Antunes, Bacharel em Biomedicina pela UFRGS, Mestrado e Doutorado pelo PPGBM/UFRGS e pós-doutorado pela Rice University (Texas/EUA).
Referências:
1a.http://www.forbes.com/sites/stevensalzberg/2015/02/01/anti-vaccine-movement-causes-worst-measles-epidemic-in-20-years/#7fbff3c97ef9
1b. http://www.cdc.gov/measles/cases-outbreaks.html
Vaccination and heterologous immunity: educating the immune system. Gil. et al., 2015. https://www.ncbi.nlm.nih.gov/pubmed/25573110
Estimating the diversity, completeness, and cross-reactivity of the T cell repertoire. Zarnitsyna et al., 2013. https://www.ncbi.nlm.nih.gov/pubmed/24421780
CD8 T cell cross-reactivity networks mediate heterologous immunity in human EBV and murine vaccinia virus infections. Cornberg at al., 2010. https://www.ncbi.nlm.nih.gov/pubmed/20164414
Hepatitis C virus infection from the perspective of heterologous immunity. Cornberg at al., 2016. https://www.ncbi.nlm.nih.gov/pubmed/26826311
Narrowing of human influenza A virus-specific T cell receptor α and β repertoires with increasing age. Gil. et al., 2015. https://www.ncbi.nlm.nih.gov/pubmed/25609818
Fonte: SBI